Bienvenidos al curso de Física Básica, en el cual se estudiara una introducción a los fenómenos físicos básicos en nuestro medio ambiente. Es un curso muy interesante el cual necesita mucha dedicación y tiempo para leer, hacer sus proyectos, resolver ejercicios y en si todas las actividades que les sean útiles, estoy para servirles y se ha creado este espacio virtual para que puedan opinar, compartir ideas y/o cualquier información importante de nuestro curso.
La física es la ciencia que estudia la Naturaleza en su sentido más amplio. La física es la ciencia básica que estudia el cosmos, es decir, el todo desde el punto de vista científico. Aunque, aparentemente, la física consiste en buscar o encontrar una materialización de la realidad observable, no es así. Continuar...
Historia de la Física
Desde la más remota antigüedad las personas han tratado de comprender la naturaleza y los fenómenos que en ella se observan: el paso de las estaciones, el movimiento de los cuerpos y de los astros, los fenómenos climáticos, las propiedades de los materiales, etc. . Continuar...
Desde la más remota antigüedad las personas han tratado de comprender la naturaleza y los fenómenos que en ella se observan: el paso de las estaciones, el movimiento de los cuerpos y de los astros, los fenómenos climáticos, las propiedades de los materiales, etc. . Continuar...
Introducción al Calculo Vectorial
El cálculo vectorial o análisis vectorial es un campo de las matemáticas referidas al análisis real multivariable de vectores en 2 o más dimensiones. Es un enfoque de la geometría diferencial como conjunto de fórmulas y técnicas para solucionar problemas muy útiles para la ingeniería y la física. Continuar...
Vector
Vector En física, un vector (también llamado vector euclidiano o vector geométrico) es una herramienta geométrica utilizada para representar una magnitud física definida por su módulo (o longitud), su dirección (u orientación) y su sentido (que distingue el origen del extremo). Continuar...
Operaciones con Vectores
Las operaciones con vectores trata de panipularse conlas cuatro operaciones fundamentales de los vectores, son los siguientes: Sumar vectores, Restar vectores, producto escalar, Producto Vectorial de Vectores. Continuar...
El cálculo vectorial o análisis vectorial es un campo de las matemáticas referidas al análisis real multivariable de vectores en 2 o más dimensiones. Es un enfoque de la geometría diferencial como conjunto de fórmulas y técnicas para solucionar problemas muy útiles para la ingeniería y la física. Continuar...
Vector
Vector En física, un vector (también llamado vector euclidiano o vector geométrico) es una herramienta geométrica utilizada para representar una magnitud física definida por su módulo (o longitud), su dirección (u orientación) y su sentido (que distingue el origen del extremo). Continuar...
Operaciones con Vectores
Las operaciones con vectores trata de panipularse conlas cuatro operaciones fundamentales de los vectores, son los siguientes: Sumar vectores, Restar vectores, producto escalar, Producto Vectorial de Vectores. Continuar...
Cinemática
La cinemática es una rama de la física que estudia las leyes del movimiento (cambios de posición) de los cuerpos, sin tomar en cuenta las causas (fuerzas) que lo producen y se limita, esencialmente, al estudio de la trayectoria en función del tiempo. Continuar...
Movimiento Rectilíneo Uniforme
Un movimiento es rectilíneo cuando el móvil describe una trayectoria recta, y es uniforme cuando su velocidad es constante en el tiempo, dado que su aceleración es nula. Nos referimos a él mediante el acrónimo MRU. Continuar...
Movimiento Rectilíneo Uniformemente Variado
El movimiento rectilíneo uniformemente acelerado (MRUA), también conocido como movimiento rectilíneo uniformemente variado (MRUV), es aquel en el que un móvil se desplaza sobre una trayectoria recta estando sometido a una aceleración constante. Continuar...
Caída Libre
En física, se denomina caída libre al movimiento de un cuerpo bajo la acción exclusiva de un campo gravitatorio. Esta definición formal excluye a todas las caídas reales influenciadas en mayor o menor medida por la resistencia aerodinámica del aire, así como a cualquier otra que tenga lugar en el seno de un fluido; Continuar...
Un movimiento es rectilíneo cuando el móvil describe una trayectoria recta, y es uniforme cuando su velocidad es constante en el tiempo, dado que su aceleración es nula. Nos referimos a él mediante el acrónimo MRU. Continuar...
Movimiento Rectilíneo Uniformemente Variado
El movimiento rectilíneo uniformemente acelerado (MRUA), también conocido como movimiento rectilíneo uniformemente variado (MRUV), es aquel en el que un móvil se desplaza sobre una trayectoria recta estando sometido a una aceleración constante. Continuar...
Caída Libre
En física, se denomina caída libre al movimiento de un cuerpo bajo la acción exclusiva de un campo gravitatorio. Esta definición formal excluye a todas las caídas reales influenciadas en mayor o menor medida por la resistencia aerodinámica del aire, así como a cualquier otra que tenga lugar en el seno de un fluido; Continuar...
Movimiento Relativo
El movimiento siempre es un concepto relativo porque debe referirse a un sistema de referencia o referencial particular escogido por el observador. Puesto que diferentes observadores pueden utilizar referenciales distintos, es importante relacionar las observaciones realizadas por aquellos. Continuar...
Movimiento Parabólico
Se denomina movimiento parabólico al realizado por un objeto cuya trayectoria describe una parábola. Se corresponde con la trayectoria ideal de un proyectil que se mueve en un medio que no ofrece resistencia al avance y que está sujeto a un campo gravitatorio uniforme. Continuar...
Movimiento Circular Uniforme (MCU)
En física, el movimiento circular uniforme describe el movimiento de un cuerpo atravesando, con rapidez constante, una trayectoria circular. Continuar...
Movimiento Circular Uniformemente Variado
Es aquel movimiento que tiene como trayectoria un circunferencia, en el cual la partícula aumenta o disminuye su velocidad angular progresivamente, por consiguiente se mueve con aceleración angular constante. Continuar...
Estática
La estática es la rama de la mecánica clásica que analiza las cargas (fuerza, par / momento) y estudia el equilibrio de fuerzas en los sistemas físicos en equilibrio estático, es decir, en un estado en el que las posiciones relativas de los subsistemas no varían con el tiempo. Continuar...
Leyes de Newton
Las leyes de Newton, también conocidas como leyes del movimiento de Newton, son tres principios a partir de los cuales se explican la mayor parte de los problemas planteados por la mecánica, en particular, aquellos relativos al movimiento de los cuerpos. Continuar...
Primera Condición de Equilibrio
Consideremos un objeto que cuelga de una cuerda, como se muestra en la figura. Sobre el objeto actúan dos fuerzas: una de ellas es la tensión de la cuerda que impide que el objeto caiga, la otra es la fuerza de gravedad, la cual actúa sobre el objeto atraiéndolo hacia abajo, a dicha fuerza la definimos como el peso del objeto. Continuar...
Teorema de Lamy
Si un cuerpo rígido en equilibrio se encuentra sometido a la acción de tres (3) fuerzas, estas deben ser coplanares y sus líneas de acción deben ser concurrentes. Continuar...
Sistema Físico, Fuerzas Internas y Externas
Se denomina sistema físico al conjunto de cuerpos articulados, o partículas interactuantes, que se desea analizar y es elegido de manera arbitraria. Sobre cada una de las partículas del sistema actúan fuerzas que pueden clasificarse en: fuerzas externas y fuerzas internas al sistema. Continuar...
Segunda Condición de Equilibrio
Para que un cuerpo esté en equilibrio derotación, debe cumplirse la segunda condición que dice: para que un cuerpo esté en equilibrio de rotación, la suma de los momentos o torques de fuerzas que actúan sobre él respecto a cualquier punto debe ser igual a cero. Continuar...
Centro de Gravedad
El centro de gravedad es el punto de aplicación de la resultante de todas las fuerzas de gravedad que actúan sobre las distintas porciones materiales de un cuerpo, de tal forma que el momento respecto a cualquier punto de esta resultante aplicada en el centro de gravedad es el mismo que el producido por los pesos de todas las masas materiales que constituyen dicho cuerpo. Continuar...
Fuerza de Rozamiento
Se define como fuerza de rozamiento o fuerza de fricción, a la fuerza entre dos superficies en contacto, a aquella que se opone al movimiento entre ambas superficies (fuerza de fricción dinámica) o a la fuerza que se opone al inicio del deslizamiento (fuerza de fricción estática). Continuar...
Dinámica
La dinámica es la parte de la física (específicamente de la mecánica clásica) que describe la evolución en el tiempo de un sistema físico en relación con las causas que provocan los cambios de estado físico y/o estado de movimiento. Continuar...
Segunda Ley de Newton
La segunda ley de Newton determina que si se aplica una fuerza a un cuerpo, éste se acelera. Continuar...
Inercia
En física, la inercia es la propiedad que tienen los cuerpos de permanecer en su estado de reposo o movimiento, mientras la fuerza neta sea igual a cero, o la resistencia que opone la materia al modificar su estado de reposo o movimiento. Continuar...
Principio de Equivalencia
El principio de equivalencia es el principio físico de la relatividad general y de varias otras teorías métricas de la gravedad. Continuar...
Dinámica Circular
Si la fuerza neta sobre un cuerpo no tiene la misma dirección de la velocidad, se rompe el equilibrio produciéndose un movimiento curvilíneo. Continuar...
Fuerza Centrífuga
Se suele decir que la fuerza centrífuga no es en sí una fuerza real, en el sentido en que esté producida por algún agente real o por interacción alguna. Continuar...
Fuerza Centrípeta
Se llama fuerza centrípeta a la fuerza, o al componente de la fuerza que actúa sobre un objeto en movimiento sobre una trayectoria curvilínea, y que está dirigida hacia el centro de curvatura de la trayectoria. Continuar...
Trabajo
En mecánica clásica, el trabajo que realiza una fuerza sobre un cuerpo equivale a la energía necesaria para desplazar este cuerpo. Continuar...
Energía
En física, «energía» se define como la capacidad para realizar un trabajo. En tecnología y economía, (energía) se refiere a un recurso natural (incluyendo a su tecnología asociada) para extraerla, transformarla y darle un uso industrial o económico. Continuar...
Energía Potencial Gravitatoria
La energía potencial gravitacional es la energía que posee un objeto, debido a su posición en un campo gravitacional. Continuar...
Energía Potencial Elástica
En un sistema físico, la energía potencial es energía que mide la capacidad que tiene dicho sistema para realizar trabajo en función exclusivamente de su posición o configuración. Continuar...
Estática de Fluidos
En este curso se van a tratar los fluidos, pero antes, y para enfocar mejor el problema se analizarán los cuerpos rígidos y los deformables, y así poder comparar unos y otros resultando de esta forma sus diferencias. Continuar...
Densidad
En física y química, la densidad (símbolo ρ) es una magnitud escalar referida a la cantidad de masa contenida en un determinado volumen de una sustancia. Continuar...
Principio de Pascal
El principio de pascal quiere decir que el incremento de la presión aplicada a una superficie de un fluido incompresible (liquido), contenido en un recipiente indeformable, se transmite con el mismo valor a cada uno de las partes del mismo. Continuar...
Presión Hidrostática
Un fluido pesa y ejerce presión sobre las paredes, sobre el fondo del recipiente que lo contiene y sobre la superficie de cualquier objeto sumergido en él. Continuar...
Presión Atmosférica
Si sobre una mesa se coloca un objeto pesado, el peso de ese cuerpo ejerce sobre la superficie de la mesa una cierta presión. Continuar...
Ley de la Gravitación Universal
La ley de gravitación universal es una ley física clásica que describe la interacción gravitatoria entre distintos cuerpos con masa. Continuar...
Campo Gravitatorio
En física, el campo gravitatorio o campo gravitacional es un campo de fuerzas que representa la gravedad. Continuar...
El Calor
El calor está definido como la forma de energía que se transfiere entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas, sin embargo en termodinámica generalmente el término calor significa simplemente transferencia de energía. Continuar...
Temperatura
La temperatura de un cuerpo indica en qué dirección se desplazará el calor al poner en contacto dos cuerpos que se encuentran a temperaturas distintas, ya que éste pasa siempre del cuerpo cuya temperatura es superior al que tiene la temperatura más baja; Continuar...
Calorimetría
La calorimetría es la ciencia de medir el calor de las reacciones químicas o de los cambios físicos. El instrumento utilizado en calorimetría se denomina calorímetro. Continuar...
Capacidad Calorífica
La capacidad calorífica de un cuerpo es el cociente entre la cantidad de energía calorífica transferida a un cuerpo o sistema en un proceso cualquiera y el cambio de temperatura que experimenta. Continuar...
Calor Latente
Se define como la cantidad de calor que necesita una sustancia para pasar del estado sólido a líquido o de líquido a gas sin cambio de temperatura. Continuar...
TEMAS RELACIONADAS




















 es el calor absorbido por el sistema.
es el calor absorbido por el sistema.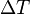 la variación de temperatura
la variación de temperatura












